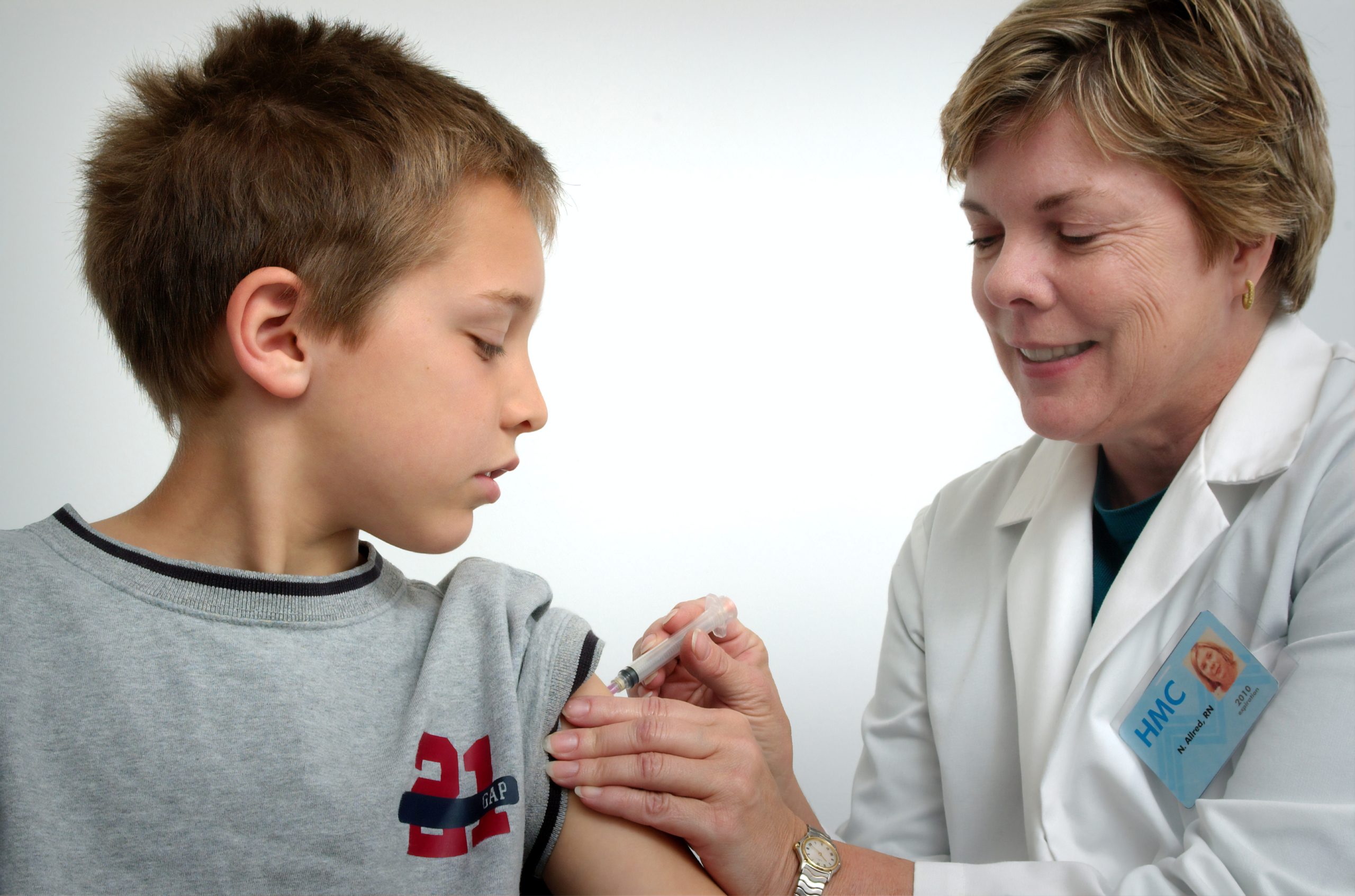
一般疫苗的研發測試需要多年的時間,但是2019新型冠狀病毒的疫苗是現在全世界研發的重心,大家都在與時間賽跑。
2019新型冠狀病毒的疫苗已進入臨床測試的共有37家,有三家已進入限制核准期。

一般每一個步驟都是分開的,但是現在很多實驗室把步驟合併。比如有些是把第一期和第二期合併。現在進入限制核准的疫苗來自於蘇俄和中國,但是他們都將第三期和限制核准期合併。蘇俄那支是於被核准兩週後才進入第三期。大部分的科學家都認為這樣合併測試期,將會出現嚴重後果。
疫苗要處理的是病毒,所以使用已上市多年的疫苗都會有風險,更何況是正在測試的疫苗。所以瑞典阿斯特捷利康製藥公司(AstraZeneca)與牛津大學合作的一支疫苗才剛因為受施者出現無法解釋的貫穿形脊髓炎而停止測試。這個計劃美國投了23億美元支援,在一/二合併期時,疫苗不但是安全的,而且也成功的引發了新型冠狀病毒的抗體。在進行二/三合併期時,測試地點位於英國、印度。第三期時測試地點是在巴西、南非及美國。
原本歐盟已跟阿斯特捷利康製藥公司達成協議,如果測試結果良好,跟他們訂四億支疫苗。
由於阿斯特捷利康製藥公司(AstraZeneca)與牛津大學合作的這支疫苗停止測試,所以也同時是身處限制核准期的另外一支疫苗公司股市大漲,那個公司是康希諾生物(CanSino Biologics)。康希諾生物與中國人民解放軍軍事醫學科學院合作研發2019新型冠狀病毒疫苗。五月通過第一期臨床測試,七月第二期施用於603人身上,宣佈疫苗顯現功效良好。於六月二十五日中國軍方宣佈核准此疫苗的使用。從八月開始康希諾生物便開始在沙烏地阿拉伯與巴基斯坦做第三期的測試。此次測試將會有5000名健康的人參與。
另外一個跑在最前面的是俄羅斯聯邦衛生部,這支疫苗是於八月十一日在還沒有進入第三期臨床測試就已被核准了。第三期測試人數將會有四萬人。
1) Institute of Medicine (US) Committee on the Children’s Vaccine Initiative: Planning Alternative Strategies; Mitchell VS, Philipose NM, Sanford JP, editors. The Children’s Vaccine Initiative: Achieving the Vision. Washington (DC): National Academies Press (US); 1993. 6, Stages of Vaccine Development.
2) HospiMedica International staff writers. (August 12, 2020). China’s CanSino Biologics Begins Final Phase of Human Trials of COVID-19 Vaccine in Saudi Arabia. Retrieved from https://www.hospimedica.com/covid-19/articles/294783931/chinas-cansino-biologics-begins-final-phase-of-human-trials-of-covid-19-vaccine-in-saudi-arabia.html